Sie möchten uns unterstützen?
Die Selbsthilfegruppe finanziert sich durch Spenden und freie Zuwendungen. Mit Ihrer Spende helfen Sie, unsere Arbeit in der Plasmozytom / Multiples Myelom Selbsthilfe zu unterstützen.
Die Diagnostik bei bösartigen Plasmazellerkrankungen fußt neben einer sorgfältigen Erhebung der Vorgeschichte des Patienten (Anamnese) und der körperlichen Untersuchung auf folgenden drei Säulen:
Die nachfolgend aufgeführten Untersuchungen sind für Patienten mit Multiplem Myelom besonders wichtig, da:
Im Einzelfall können weitere Untersuchungen notwendig sein.
Eiweißbestimmung (Proteinbestimmung):
Bei nahezu allen Patienten mit Multiplem Myelom produzieren die Myelomzellen Immunglobuline (Antikörper), die aus schweren und leichten Eiweißketten aufgebaut sind. Mit der Immunfixations-Elektrophorese (kurz "Immunfixation") lässt sich nachweisen, dass ein erhöhter Eiweißwert im Blut auf die Anwesenheit untereinander identischer Plasmazellen - sogenannte "klonale" Zellen, also Tumorzellen - zurückzuführen ist ("positive Immunfixation" mit Nachweis klar umschriebener Banden; Abbildung 1). Dies wird als monoklonale Gammopathie bezeichnet.
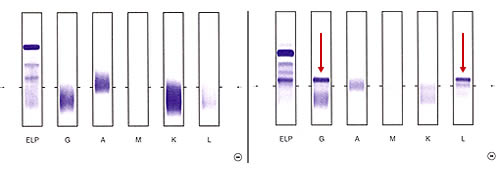
Negative (normale; links) und positive (krankhafte, rechts) Immunfixations-Elektrophorese. Als positiv gilt eine Immunfixation bei Nachweis klar umschriebener Banden (Pfeile). Im vorliegenden Fall existiert ein Paraprotein vom Typ IgG Lambda.
Bei vielen internistischen Erkrankungen (Lebererkrankungen, rheumatischen Erkrankungen) kann es zu einer Erhöhung des Gesamteiweißwertes im Blut kommen, ohne dass dies Folge einer Plasmazellerkrankung ist (polyklonale Immunglobulinvermehrung).
Bei erstmaligem Nachweis eines monoklonalen Proteins ("Paraprotein") im Labor muss immer eine gutartige oder bösartige Bluterkrankung ausgeschlossen werden. Es gibt unterschiedliche "Paraproteine", wobei die häufigsten die vom Typ IgG und IgA sind. Werden von der Tumorzelle nur leichte Ketten des Immunglobulins gebildet, spricht man von einem Leichtketten-Myelom.
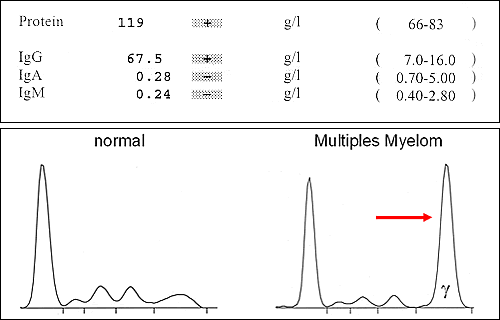
Die Mengenbestimmung (Quantifizierung) des Paraproteins spielt bei der Betreuung von Myelompatienten eine wichtige Rolle, da die Menge des Paraproteins die Aktivität der Erkrankung widerspiegelt (ansteigende Eiweißwerte = zunehmende Krankheitsaktivität, abfallende Eiweißwerte = rückläufige Krankheitsaktivität, z.B. unter erfolgreicher Therapie). Die Paraprotein-Quantifizierung kann mittels einer Serum-Eiweißelektrophorese oder direkt "nephelometrisch" erfolgen (Abbildung 2).
Bei Leichtketten-Myelomen erfolgte viele Jahre die Bestimmung des Tumoreiweißes nur aus einem 24 Stunden-Sammelurin (Leichtketten können den Nierenfilter überwinden und werden im Urin ausgeschieden). Heutzutage kann die Bestimmung der freien Leichtketten auch im Serum mit dem sogenannten "Freelite"-Test erfolgen. Es wird allerdings empfohlen, beide Verfahren parallel einzusetzen, da die Ergebnisse für verschiedene Fragestellungen herangezogen werden.
Die Bestimmung der freien Leichtketten im Serum und die Immunfixations-Elektrophorese gelten heute als die empfindlichsten Routine-Messmethoden zum Nachweis monoklonaler Eiweiße. Eine Normalisierung der Werte der freien Leichtketten im Serum (und somit Normalisierung des Leichtketten-Quotienten) sowie eine negative Immunfixations-Elektrophorese zeigen ein sehr weitgehendes Zurückdrängen der Myelomerkrankung an ("komplette Remission").
Die Gewinnung von Knochenmarkproben kann prinzipiell auf zwei Wegen erfolgen:
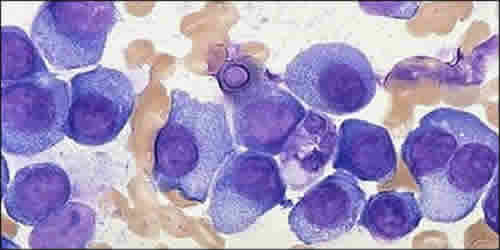
durch eine Knochenmark-Aspiration (Entnahme von flüssigem Knochenmarkblut durch eine Punktion des Knochenmarkraumes) unter örtlicher Betäubung. Das flüssige Knochenmark wird auf Glasobjektträger ausgestrichen und gefärbt. Anschließend kann der prozentuale Anteil von Plasmazellen und deren Gestalt unter einem Mikroskop begutachtet werden ("Knochenmark-Aspirationszytologie"; Abbildung 3).
durch eine Knochenstanze (Gewinnung eines Knochenzylinders). Die Knochenstanze wird zunächst in einem mehrtägigen Prozess aufgearbeitet, eingebettet und geschnitten. Die Beurteilung erfolgt häufig durch einen Facharzt für Pathologie. Die Gestalt der einzelnen Zelle kann durch dieses Verfahren im Vergleich zur Knochenmarkzytologie weniger gut beurteilt werden. Es erlaubt jedoch eine bessere Beurteilung der Gesamtzusammensetzung der Blutzellen im Knochenmark und die Durchführung bestimmter Färbungen, die im Einzelfall zur Charakterisierung der Erkrankung notwendig sein können. Um die Diagnose einer bösartigen Plasmazellerkrankung zu stellen, ist in der Regel die Knochenmark-Aspiration ausreichend. Es wird jedoch empfohlen, zumindest bei der Erstuntersuchung beide Verfahren einzusetzen.
Für die Verlaufsbeurteilung ist eine Knochenmarkuntersuchung meist nicht zwingend erforderlich. Im Rahmen von Therapiestudien kann eine Untersuchung des Knochenmarkes gefordert werden, um das Ansprechen auf eine Studienbehandlung möglichst exakt zu bestimmen. Eine Knochenmarkpunktion kann unter Umständen auch zur Gewinnung von Frischmaterial (z.B. zur Durchführung genetischer Analysen) notwendig sein. Die Knochenmarkpunktion ist in der Hand eines erfahrenen Untersuchers und unter lokaler Betäubung ein meist unkompliziertes Verfahren.
Mit der MRD Bestimmung wird versucht ein noch besseres Ansprechen nachzuweisen als mit der bisherigen Bestimmung der kompletten Remission. Das Ziel ist 1. eine bessere Aussage zum Krankheitsverlauf machen zu können als bisher und 2. die Therapie hiermit steuern zu können.
Zu 1.: Studiengruppen gingen davon aus, mit der MRD Bestimmung das Überleben vorhersagen zu können. Grundsätzlich ist es natürlich so, dass es von Vorteil ist, wenn die Erkrankung nach der Therapie verschwunden ist, als wenn sie immer noch nachweisbar ist. Darüber hinaus gibt es aber viele Faktoren, die das Überleben beeinflussen, z.B. genetische Veränderungen oder Nebenwirkungen der Therapie. Des Weiteren gibt es verschiedene Verfahren zur Bestimmung der MRD, die nicht (immer) vergleichbar sind. Da die MRD Bestimmung auch noch eine (zusätzliche) Knochenmarkpunktion erfordert, hat sich diese Untersuchung außerhalb von Studien (noch) nicht durchgesetzt.
Zu 2.: als zweites besteht die Idee, dass man bei Pat. mit einer negativen MRD (also keine krankhafte Plasmazellen mehr unter 100.000 oder 1 Million untersuchten Zellen) die Therapie stoppen kann. Das hat sich aktuell in einer Studie, insbesondere bei Pat. mit einem hohen genetischen Risiko, nicht bestätigt. Weiterhin wir untersucht, ob bei Pat. mit noch nachweisbarer Resterkrankung eine Therapieintensivierung einen Nutzen hat. Entsprechende Studien laufen. Insgesamt erlauben die bisherigen Daten nicht die Therapie anhand der MRD Bestimmung zu steuern, weswegen die MRD Testung weiterhin nur in Studien eingesetzt werden sollte.
Seit vielen Jahren sind bestimmte genetische Veränderungen bekannt, die mit einem rascheren Krankheitsrückfall vergesellschaftet sind, als andere. Hierzu zählen z.B. Deletion del17, Translokation t(4;14) und t(14;16). Darüber hinaus zählen Zugewinne am Chromosom 1, amp 1q21 oder gain 1q21, hinzu. In aktuellen Studien werden auch noch andere Veränderungen aufgezählt. Hierzu gibt es mehrere Probleme: a. das Risiko der Veränderungen ist unterschiedlich. Nicht alle sind gleich „hoch Risiko“. b. das erhöhte Risiko hängt auch von der Therapie ab, d.h. mit einer anderen Therapie ist das Risiko vielleicht gar nicht mehr (so) erhöht. c. die Bestimmung der Veränderungen ist in unterschiedlichen Studien unterschiedlich.
Das bedeutet, dass es zunehmend schwieriger wird, Daten oder Studien zu vergleichen. Das was in der einen Studie „Hochrisiko“ ist, ist in einer anderen Studie Standardrisiko. Dazu kommt, dass bisher kaum therapeutische Konsequenzen aus diesen genetischen Veränderungen gezogen werden. Im Wesentlichen neigt man bei Hochrisikopatienten bei der Erstlinienbehandlung eher zur Durchführung einer Doppeltransplantation. Andere Auswirkungen auf die Therapie (außerhalb von Studien) gibt es derzeit praktisch nicht. Vermutlich wird sich das in Zukunft ändern.
Der Einsatz bildgebender Verfahren dient an erster Stelle dem Nachweis von myelombedingten Knochen- und Knochenmarkveränderungen. Diese treten typischerweise in Form sogenannter Osteolysen (örtlich umschriebener Knochenauflösungszonen; Abbildung A) und fokaler Plasmazellansammlungen im Knochenmark auf (Abbildung 4B).
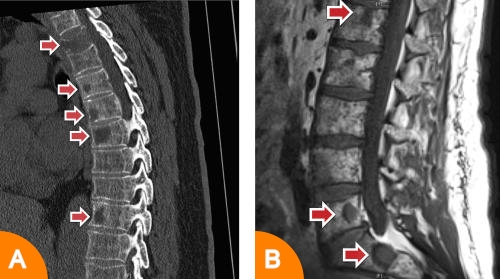
Ebenfalls häufig zeigt sich aber auch eine Osteoporose (diffuse Verminderung der Knochensubstanz) oder ein diffuser Befall des Knochenmarks.
Klassisches bildgebendes Verfahren war lange Zeit das konventionelle Röntgen zur Darstellung des Schädels, der Wirbelsäule, des Beckens sowie der langen Röhrenknochen (Oberarmknochen, Oberschenkelknochen), auch als "Pariser Schema" bezeichnet. Allerdings ist dieses Verfahren mit einer Reihe von Nachteilen bzw. Einschränkungen behaftet: Es ist relativ aufwendig und hat eine im Vergleich zu anderen Techniken schlechte Sensitivität (Empfindlichkeit). Darüber hinaus wird eine myelombedingte Knochenzerstörung oft erst sichtbar, wenn 30-50% der Knochensubstanz abgebaut ist. Aus diesem Grund kommen andere bildgebende Verfahren beim Multiplen Myelom bevorzugt zum Einsatz. Hierzu zählen die Computertomografie (CT), die sich besonders zur Beurteilung von Knochensubstanz bei Verdacht auf eine Instabilität des Knochens mit drohender Bruchgefahr (z.B. von Wirbelkörpern) eignet und die Magnetresonanztomografie (MRT), die besonders gut die nicht knöchernen Gewebe (z.B. Nervenstränge und Knochenmark) abbildet.
Der Stellenwert der kombinierten PET/CT (PET = Positronenemissionstomografie), siehe Abbildung 5, wird bereits seit mehreren Jahren untersucht. Diese Untersuchungstechnik ist allerdings weiterhin kein Routineverfahren in der Diagnostik des Multiplen Myeloms.
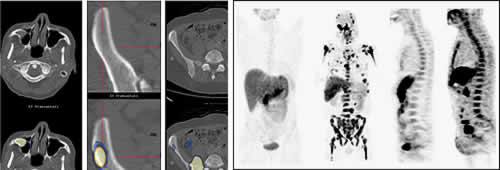
Die PET ist ein Verfahren, welches auf der gesteigerten Stoffwechselaktivität von Tumorzellen beruht (rechts). Kombiniert wird die PET mit einem Verfahren zur Darstellung der Knochensubstanz (CT; links), wodurch eine Abbildung von Myelomherden im Knochenmark und außerhalb des Knochenmarks möglich wird.
Autoren:
PD Dr. med. Peter Liebisch, überarbeitet 2015 Von Prof. Jens Hillengaß, 2023 aktualisiert von Dr. Salwender Asklepios-Tumorzentrum Hamburg